2024年成考高起点《理化综合》每日一练试题11月26日
2024-11-26 12:10:02 来源:吉格考试网
2024年成考高起点《理化综合》每日一练试题11月26日,可以帮助我们积累知识点和做题经验,进而提升做题速度。通过成考高起点每日一练的积累,助力我们更容易取得最后的成功。
单选题
1、如图8-7所示,在x轴原点O处放置一电荷量q1=-Q的负电荷,在x=10cm处放置一电荷量q2=+Q的正电荷,则以下区域中.q1、q2在x轴上产生合场强的方向指向-x轴方向的是()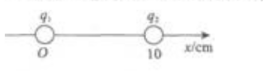
- A:0<x<10cm
- B:x>10cm
- C:-5cm<x<10cm
- D:x<-5cm
答 案:A
2、某原子核放出-a粒子,则生成的原子核与原来的原子核相比,质子数和中子数分别减少()。
- A:2和2
- B:2和4
- C:4和2
- D:4和4
答 案:A
多选题
1、某溶液中有NH4+、Mg2+、Al3+、Fe2+等4种离子, 若向其中加入过量的 NaOH溶液, 微热并搅拌, 再加入过量的盐酸, 溶液中大量减少的阳离子是
- A:NH4+
- B:Mg2+
- C:Fe2+
- D:Al3+
答 案:AC
主观题
1、如图,一质量为m1的木块静置在光滑的水平面上,一质量为m2的子弹以速度v0水平射入木块,进入木块s距离后相对木块静止。设子弹相对木块静止前受到的阻力恒定。求从子弹开始进入到相对木块静止这段时间内
(1)子弹与木块组成的系统损失的机械能。
(2)木块移动的距离。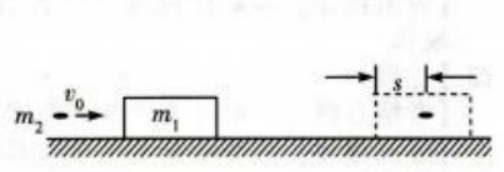
答 案:(1)根据动量守恒定律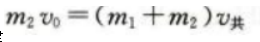 根据功能关系
根据功能关系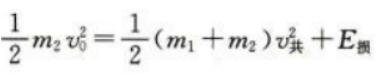
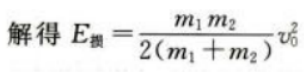 (2)设子弹与木块间摩擦力为f,则E损=fs设物块运动距离为L,对物块运用动能定理
(2)设子弹与木块间摩擦力为f,则E损=fs设物块运动距离为L,对物块运用动能定理
2、工业上用焙烧NaHCO3的方法生产纯碱(Na2CO3)。现有17.5g的NaHCO3样品,加热分解完全后,生成标准状况下的CO2气体2.24L。写出NaHCO3分解反应的化学方程式,计算此NaHCO3样品的纯度。
答 案:NaHCO3分解反应的化学方程式如下: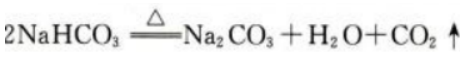 反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
填空题
1、为防止污染环境,工业上利用氨氧化法制 其尾气用()吸收;工业上利用接触法制硫酸,其尾气用()吸收。
其尾气用()吸收;工业上利用接触法制硫酸,其尾气用()吸收。
答 案:NaOH溶液;氨水
解 析:工业上用氨氧化法制硝酸,其尾气中含有少量的 的混合气体,可以用NaOH吸收,使其变成亚硝酸钠;
的混合气体,可以用NaOH吸收,使其变成亚硝酸钠;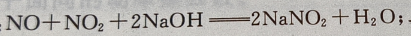 工业上利用接触法制硫酸的尾气中的
工业上利用接触法制硫酸的尾气中的 可用氨水吸收,使其成为化肥
可用氨水吸收,使其成为化肥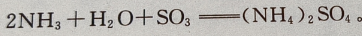
2、FeCl3溶液中先通入过量的SO2,再滴加BaCl2溶液,产生的白色沉淀为()(填化学式),说明SO,具有()性。
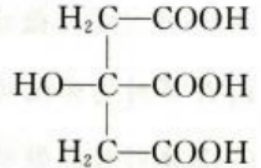
答 案:BaSO₄;还原
解 析:本题考查了二氧化硫的性质的知识点。 二氧化硫具有还原性,能与氧化铁发生氧化还原反应生成硫酸根,可用氯化钡检验生成的硫酸根。
简答题
1、一个质量M=0.20kg的小球放在高度h=5.0m的直杆顶端,如图5—16。一颗质量m=0.010kg的子弹以v0;5.0×102m/s的速度沿水平方向击中小球,并穿过球心,小球落地处离杆的距离s=20m,求子弹落地处离杆的距离(g取10m/s2)。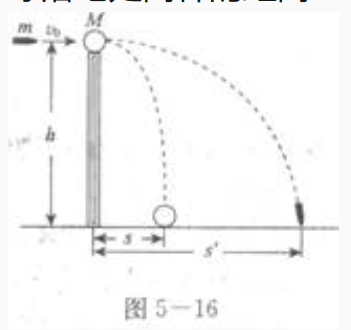
答 案:
2、合成氨工业生产中所用的a-Fe催化剂的主要成分是FeO、Fe2O3,当催化剂中FeO与Fe2O3的物质的量之比为1:1时,其催化活性最高。现以Fe和Fe2O3为原料制备这种催化剂,有关反应为: 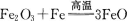 计算应向480g Fe2O3粉末中加入铁粉的质量。
计算应向480g Fe2O3粉末中加入铁粉的质量。
答 案:



