2024年成考高起点《理化综合》每日一练试题11月11日,可以帮助我们积累知识点和做题经验,进而提升做题速度。通过成考高起点每日一练的积累,助力我们更容易取得最后的成功。
单选题
1、维修电炉时,将电炉丝的长度缩短十分之一,则修理前电炉的功率与维修后的功率之比为()
- A:9:10
- B:10:9
- C:10:11
- D:11:10
答 案:A
解 析:设维修前电炉丝的电阻为R,则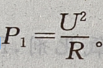 由题意知维修后电炉丝的电阻变为
由题意知维修后电炉丝的电阻变为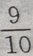 R,则
R,则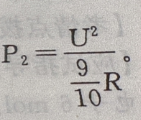 则P1:P2=9:10
则P1:P2=9:10
2、图甲所示为一单摆,e为平衡位置,位置g、f偏离平衡位置最远。以单摆偏离平衡位置向右的位移为正,其振动曲线如图乙所示。则图乙中a、b、c、d各点对应于图甲所示的单摆运动过程中的位置分别是()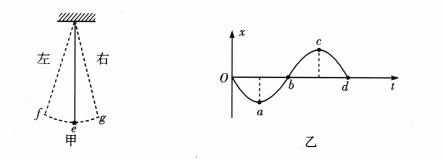
- A:e、g、e、f
- B:f、e、g、e
- C:g、e、f、e
- D:e、f、e、g
答 案:B
解 析:因以向右为振动正方向,而a点为负,故为向左最远点,即为f点,同理,b、c、d点为e、g、e点,B项正确。
多选题
1、某溶液中有NH4+、Mg2+、Al3+、Fe2+等4种离子, 若向其中加入过量的 NaOH溶液, 微热并搅拌, 再加入过量的盐酸, 溶液中大量减少的阳离子是
答 案:AC
主观题
1、如图,一质量为m1的木块静置在光滑的水平面上,一质量为m2的子弹以速度v0水平射入木块,进入木块s距离后相对木块静止。设子弹相对木块静止前受到的阻力恒定。求从子弹开始进入到相对木块静止这段时间内
(1)子弹与木块组成的系统损失的机械能。
(2)木块移动的距离。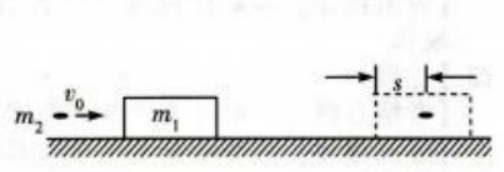
答 案:(1)根据动量守恒定律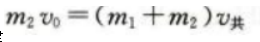 根据功能关系
根据功能关系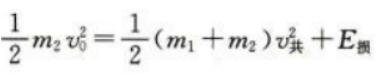
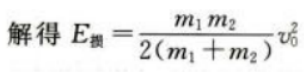 (2)设子弹与木块间摩擦力为f,则E损=fs设物块运动距离为L,对物块运用动能定理
(2)设子弹与木块间摩擦力为f,则E损=fs设物块运动距离为L,对物块运用动能定理
2、工业上用焙烧NaHCO3的方法生产纯碱(Na2CO3)。现有17.5g的NaHCO3样品,加热分解完全后,生成标准状况下的CO2气体2.24L。写出NaHCO3分解反应的化学方程式,计算此NaHCO3样品的纯度。
答 案:NaHCO3分解反应的化学方程式如下: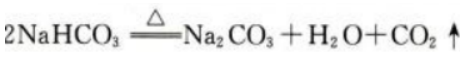 反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
填空题
1、如图3-6所示,一根细绳的两端分别系于A点和B点,在O点处悬挂一个重物,质量m=10kg,物体处于静止状态,则绳OB的张力是______。(g取10m/s2。) 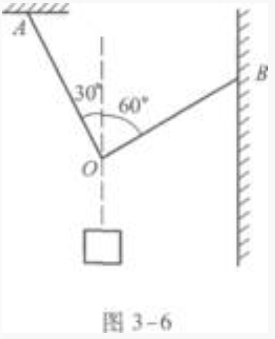
答 案:50N
解 析:本题考查的知识点是三个共点力的平衡问题。 先对物体m进行受力分析,m受两个作用力:竖直向下的重力G,竖直向上的绳子拉力F'。物体处于静止状态,所以G和F'是一对平衡力,根据平衡条件知。 F'=G=mg
再对O点作受力分析。O点处受到三个作用力:绳子OA的拉力FA,方向沿OA绳子向上;绳子OB的拉力FB,方向沿OB绳向上;下面绳子竖直向下的拉力F。图3-13是受力图。
由图知,FA、FB是相互垂直的。因此,在用力的平衡条件解题时,取OB方向为分解力的两个方向之一是最方便的。
根据力的平衡条件,FA、F在OB方向上分力之和等于FB。因为FA垂直于FB,它在OB方向上的分量为零,所以F在OB方向上的分力就等于FB。由此可知 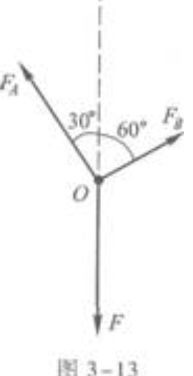 Fcos60°=FB.
Fcos60°=FB.
因此FB绳子的张力为
FB=Fcos60°=F'cos60°=mgcos60°
代入题给数值得
FB=10×10×cos60°N=50N
注意,在三个共点力平衡的问题中,通常可以取水平方向和竖直方向为分解力的两个方向。
根据力的平衡条件,沿水平方向有
FAsin30°=FBsin60°①
沿竖直方向有
FAcos30°+FBcos60°=F=mg②
由式①、②解得 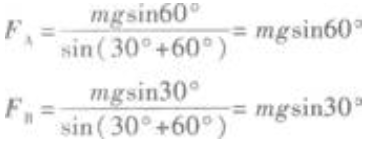 显然,FA、FB的合力是F的平衡力-F,因为FA、FB相互垂直,所以由直角三角形的知识知FB=Fcos60°
显然,FA、FB的合力是F的平衡力-F,因为FA、FB相互垂直,所以由直角三角形的知识知FB=Fcos60°
2、通常情况下,钠在空气中燃烧火焰呈黄色;氢气在氯气中燃烧火焰呈()色,甲烷在空气中燃烧火焰呈()色
答 案:苍白;淡蓝
解 析:根据物质的性质及实验现象可得。
简答题
1、在相同条件下,0.1molZn和0.1molAl分别跟足量的稀盐酸反应,哪个反应放出的氢气多?
答 案:锌和铝分别跟稀盐酸反应的化学方程式是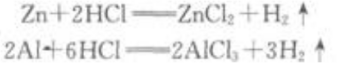 从方程式可知1molZn跟足量的稀盐酸反应,可以放出1molH2;1mol Al跟足量的稀盐酸反应,可以放出1.5 mol H2.由此可知,0.1mol AI跟足量的稀盐酸反应放出的氢气比0.1molZn放出的多.
答:0.1mol AI与足量的稀盐酸反应放出的氢气多
从方程式可知1molZn跟足量的稀盐酸反应,可以放出1molH2;1mol Al跟足量的稀盐酸反应,可以放出1.5 mol H2.由此可知,0.1mol AI跟足量的稀盐酸反应放出的氢气比0.1molZn放出的多.
答:0.1mol AI与足量的稀盐酸反应放出的氢气多
2、往50mL稀硫酸和稀盐酸的混合溶液中加入2.1375g氢氧化钡粉末,充分反应后进行过滤,滤液的pH=13,其沉淀干燥后质量为1.165g试计算原混合溶液中的物质的量浓度
答 案:加入的Ba(OH)2的物质的量为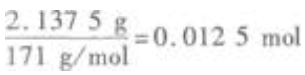 所得的沉淀是BaSO4,其物质的量为
所得的沉淀是BaSO4,其物质的量为  解得
解得
x=y=0.005 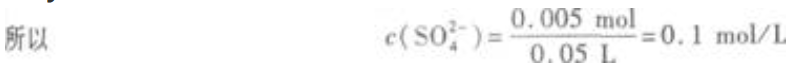 (2)溶液的pH=13,说明有Ba(OH)2剩余,且c(OH-)=0.1mol/L。 n(OH-)=0.1mol/L×0.05L=0.005mol
(2)溶液的pH=13,说明有Ba(OH)2剩余,且c(OH-)=0.1mol/L。 n(OH-)=0.1mol/L×0.05L=0.005mol
设剩余的Ba(OH)2为2mol,则 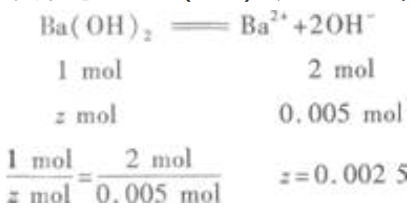 即剩余Ba(OH)20.0025mol。
即剩余Ba(OH)20.0025mol。
与HCl反应的Ba(OH)2的物质的量为0.0125mol-0.005mol-0.0O25mol=0.005mol
设溶液中HCl(Cl-)的物质的量为mmol,则 
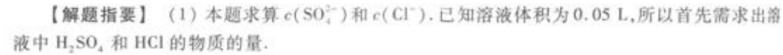 (2)H2SO4和HCl的混合溶液中加入Ba(OH)2后,只有H2SO4与其反应生成BaSO4沉淀,所以根据沉淀的质量(即BaSO4的质量)可求出凡(H2SO4)。
(2)H2SO4和HCl的混合溶液中加入Ba(OH)2后,只有H2SO4与其反应生成BaSO4沉淀,所以根据沉淀的质量(即BaSO4的质量)可求出凡(H2SO4)。
(3)因滤液的pH=13,可知Ba(OH)2与H2SO4、HCl反应后,仍有剩余。即加入的Ba(OH)2分为三部分:①与H2SO4反应,②与HCl反应,③剩余。根据BaSO4的物质的量可求出H2SO4消耗的Ba(OH)2,根据剩余溶液的pH=13可求得剩余的Ba(OH)2。所以用Ba(OH)2的总量,减去H2SO4消耗的量,再减去剩余的量,最后可得与HCl反应的Ba(OH)2的物质的量,并进一步由Ba(OH)2的物质的量求得HCl的物质的量。
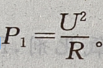 由题意知维修后电炉丝的电阻变为
由题意知维修后电炉丝的电阻变为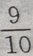 R,则
R,则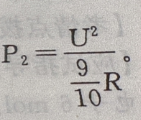 则P1:P2=9:10
则P1:P2=9:10

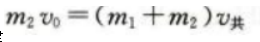 根据功能关系
根据功能关系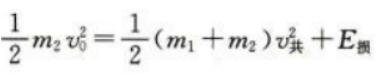
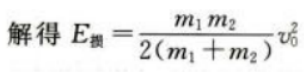 (2)设子弹与木块间摩擦力为f,则E损=fs设物块运动距离为L,对物块运用动能定理
(2)设子弹与木块间摩擦力为f,则E损=fs设物块运动距离为L,对物块运用动能定理
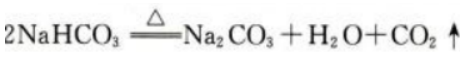 反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
 Fcos60°=FB.
Fcos60°=FB.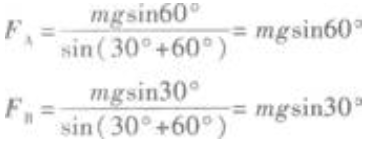 显然,FA、FB的合力是F的平衡力-F,因为FA、FB相互垂直,所以由直角三角形的知识知FB=Fcos60°
显然,FA、FB的合力是F的平衡力-F,因为FA、FB相互垂直,所以由直角三角形的知识知FB=Fcos60°
 从方程式可知1molZn跟足量的稀盐酸反应,可以放出1molH2;1mol Al跟足量的稀盐酸反应,可以放出1.5 mol H2.由此可知,0.1mol AI跟足量的稀盐酸反应放出的氢气比0.1molZn放出的多.
答:0.1mol AI与足量的稀盐酸反应放出的氢气多
从方程式可知1molZn跟足量的稀盐酸反应,可以放出1molH2;1mol Al跟足量的稀盐酸反应,可以放出1.5 mol H2.由此可知,0.1mol AI跟足量的稀盐酸反应放出的氢气比0.1molZn放出的多.
答:0.1mol AI与足量的稀盐酸反应放出的氢气多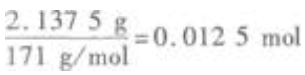 所得的沉淀是BaSO4,其物质的量为
所得的沉淀是BaSO4,其物质的量为  解得
解得 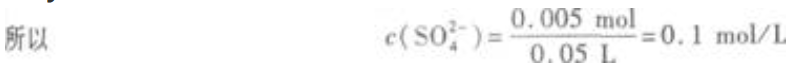 (2)溶液的pH=13,说明有Ba(OH)2剩余,且c(OH-)=0.1mol/L。 n(OH-)=0.1mol/L×0.05L=0.005mol
(2)溶液的pH=13,说明有Ba(OH)2剩余,且c(OH-)=0.1mol/L。 n(OH-)=0.1mol/L×0.05L=0.005mol 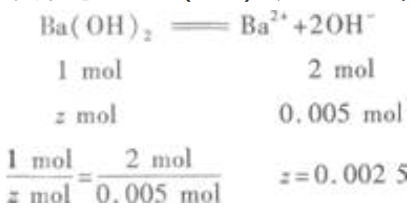 即剩余Ba(OH)20.0025mol。
即剩余Ba(OH)20.0025mol。 
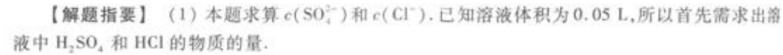 (2)H2SO4和HCl的混合溶液中加入Ba(OH)2后,只有H2SO4与其反应生成BaSO4沉淀,所以根据沉淀的质量(即BaSO4的质量)可求出凡(H2SO4)。
(2)H2SO4和HCl的混合溶液中加入Ba(OH)2后,只有H2SO4与其反应生成BaSO4沉淀,所以根据沉淀的质量(即BaSO4的质量)可求出凡(H2SO4)。 


