2024年成考高起点《理化综合》每日一练试题10月30日
2024-10-30 12:02:27 来源:吉格考试网
2024年成考高起点《理化综合》每日一练试题10月30日,可以帮助我们积累知识点和做题经验,进而提升做题速度。通过成考高起点每日一练的积累,助力我们更容易取得最后的成功。
单选题
1、在已经处于化学平衡状态的体系中,如果下列量发生改变,其中一定能表明平衡移动的是()。
- A:反应混合物的浓度
- B:反应物的转化率
- C:正逆反应速率
- D:反应混合物的压强
答 案:B
2、下列物质中,不能用于漂白或脱色的是()
- A:氯水
- B:
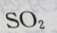
- C:活性炭
- D:
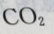
答 案:D
解 析:氯水中含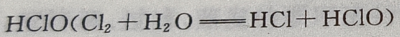 含漂白作用,
含漂白作用,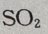 也具有漂白特性,活性炭具有吸附性,具有脱色特性。
也具有漂白特性,活性炭具有吸附性,具有脱色特性。
多选题
1、某溶液中有NH4+、Mg2+、Al3+、Fe2+等4种离子, 若向其中加入过量的 NaOH溶液, 微热并搅拌, 再加入过量的盐酸, 溶液中大量减少的阳离子是
- A:NH4+
- B:Mg2+
- C:Fe2+
- D:Al3+
答 案:AC
主观题
1、一绝缘细绳上端固定,下端连接在一质量m=0.08kg、长度l=0.4m的均匀金属棒中心,整个装置处在一匀强磁场中,磁场的磁感应强度大小B=0.5T,方向竖直向上,如图所示。现使一电流流过金属棒,已知电流大小I=3A,方向垂直于纸面向里,重力加速度大小g取10m/s2。求
(1)金属棒所受安培力的大小和方向。
(2)平衡后细绳中张力的大小及细绳与竖直方向夹角的正切值。
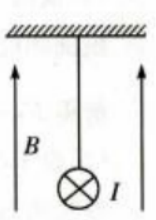
答 案:.(1)金属棒所受安培力为F=BIL=0.6N,根据左手定则知,方向水平向右。 (2)金属棒所受重力为G=mg=0.8N平衡后,安培力与重力的合力与绳中张力等大反向,设细绳与竖直方向的夹角为θ,则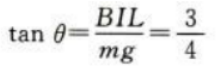 绳中张力大小为
绳中张力大小为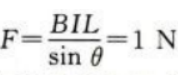
2、工业上用焙烧NaHCO3的方法生产纯碱(Na2CO3)。现有17.5g的NaHCO3样品,加热分解完全后,生成标准状况下的CO2气体2.24L。写出NaHCO3分解反应的化学方程式,计算此NaHCO3样品的纯度。
答 案:NaHCO3分解反应的化学方程式如下: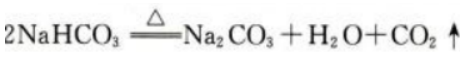 反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
填空题
1、一质点沿x轴运动,其位置随时间变化的图像如图所示。由图可知,质点在1s和4s时的瞬时速度分别为()m/s、()m/s;质点0~6s这段时间内的平均速度为()m/s。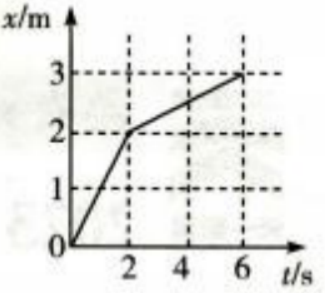
答 案:1;0.25;0.5
解 析:本题考查了瞬时速度、平均速度的知识点。 根据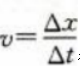 得1s时的速度为1m/s,4s时的速度为0.25m/s,6s内的平均速度为0.5m/s。
得1s时的速度为1m/s,4s时的速度为0.25m/s,6s内的平均速度为0.5m/s。
2、按系统命名法,有机物 的名称为()。
的名称为()。
答 案:3-甲基-4乙基已烷
简答题
1、把17ml.36.2%HCI溶液(密度1.18g/cm3)用水稀释至1L,稀释后溶液中HCI的物质的量浓度是多少?取稀释后的溶液200mL跟过量的锌粉反应,生成多少升(标准状况)氢气?
答 案:HCl的物质的量为 
2、一定质量的某铝屑和铁屑的混合物与足量稀硫酸反应后放出氢气8.96L(标准状况),同质量的此混合物与足量的氢氧化钠溶液反应,放出氢气6.72L(标准状况),求混合物中铝和铁的质量。
答 案: 答:原混合物中铝的质量为5.4g,铁的质量为5.6g。
答:原混合物中铝的质量为5.4g,铁的质量为5.6g。



