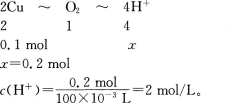2024年成考高起点《理化综合》每日一练试题12月17日
2024-12-17 11:57:41 来源:吉格考试网
2024年成考高起点《理化综合》每日一练试题12月17日,可以帮助我们积累知识点和做题经验,进而提升做题速度。通过成考高起点每日一练的积累,助力我们更容易取得最后的成功。
单选题
1、关于磁感线和电场线,下列说法中正确的是()
- A:磁感线是闭合曲线,而静电场线不是闭合曲线
- B:磁感线和电场线都是一些互相平行的曲线
- C:磁感线起始于N极,终止于S极;电场线起始于正电荷,终止于负电荷
- D:磁感线和电场线都只能分别表示磁场和电场的方向
答 案:A
解 析:磁感线是闭合曲线,其疏密程度可表示磁感应强度的大小。电场线起始于正电荷,终止于负电荷,不是闭合曲线,其疏密程度可表示电场强度的大小。由此可知 A对。
2、用一种试剂就能同时鉴别Na2CO3、BaCl2、Na2SO4三种无色溶液的是()。
- A:Ba(NO3)2溶液
- B:稀硫酸
- C:NaOH溶液
- D:稀HCI
答 案:B
多选题
1、某溶液中有NH4+、Mg2+、Al3+、Fe2+等4种离子, 若向其中加入过量的 NaOH溶液, 微热并搅拌, 再加入过量的盐酸, 溶液中大量减少的阳离子是
- A:NH4+
- B:Mg2+
- C:Fe2+
- D:Al3+
答 案:AC
主观题
1、如图,一质量为m1的木块静置在光滑的水平面上,一质量为m2的子弹以速度v0水平射入木块,进入木块s距离后相对木块静止。设子弹相对木块静止前受到的阻力恒定。求从子弹开始进入到相对木块静止这段时间内
(1)子弹与木块组成的系统损失的机械能。
(2)木块移动的距离。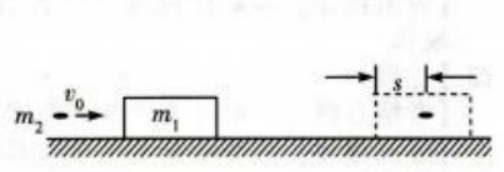
答 案:(1)根据动量守恒定律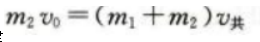 根据功能关系
根据功能关系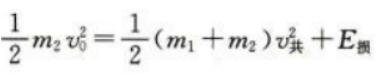
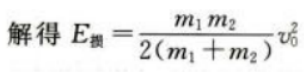 (2)设子弹与木块间摩擦力为f,则E损=fs设物块运动距离为L,对物块运用动能定理
(2)设子弹与木块间摩擦力为f,则E损=fs设物块运动距离为L,对物块运用动能定理
2、工业上用焙烧NaHCO3的方法生产纯碱(Na2CO3)。现有17.5g的NaHCO3样品,加热分解完全后,生成标准状况下的CO2气体2.24L。写出NaHCO3分解反应的化学方程式,计算此NaHCO3样品的纯度。
答 案:NaHCO3分解反应的化学方程式如下: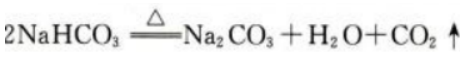 反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
反应生成标准状况下的CO2气体2.24L,其物质的量为0.1mol,故加热完全分解的NaHCO3的物质的量为0.2mol,质量为16.8g,此NaHCO3样品的质量为17.5g,所以此NaHCO3样品的纯度为16.8g/17.5g×100%=96%。
填空题
1、元素X、Y、Z均为短周期元素,且原子序数依次增大,在一定条件下,X能跟Y化合,生成无色无味的气态物质XY2。0.1molZ的单质跟足量盐酸反应,生成2.24L(标准状况下)氢气。则XY2的化学式为______,Y的原子结构示意图为______,Z的元素符号是______。
答 案: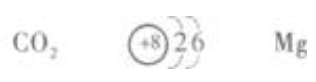
解 析:(1)X、Y为短周期元素,能相互化合生成无色无味的气态物质XY2。首先考虑符合XY2形式的气体只有CO2、SO2和NO2。其中,NO2有色又有味,SO2无色但有刺激性气味,只有CO2无色无味。所以X为C元素,Y为O元素。 (2)Z的单质与盐酸反应,可生成氢气。所以Z必是金属元素。用M表示该金属,并设其化合价为x,可写出Z与盐酸反应的化学方程式:  该金属为C、O元素之后的短周期元素,所以只能是Mg。
该金属为C、O元素之后的短周期元素,所以只能是Mg。
2、一种无色透明的溶液中可能含有下列离子: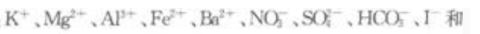
 取该溶液进行如下实验:(1)将溶液滴在pH试纸上,试纸显红色。
取该溶液进行如下实验:(1)将溶液滴在pH试纸上,试纸显红色。
(2)将少许溶液浓缩后加入铜片和硫酸,有无色气体析出,此气体遇空气则立即变为红棕色。
(3)取少许溶液滴入 BaCl2溶液,产生白色沉淀.
(4)取实验(3)中的澄清溶液滴入 AgNO3试液,产生不溶于稀 HNO3的白色沉淀
(5)另取少许溶液滴入NaOH溶液,有白色沉淀生成。当NaOH过量时,又有部分白色沉淀溶解。
根据以上现象判断,原溶液中肯定不存在的离子是______;肯定存在的离子是______;不能作出判断的离子是______。写出各步反应的离子方程式______。
答 案: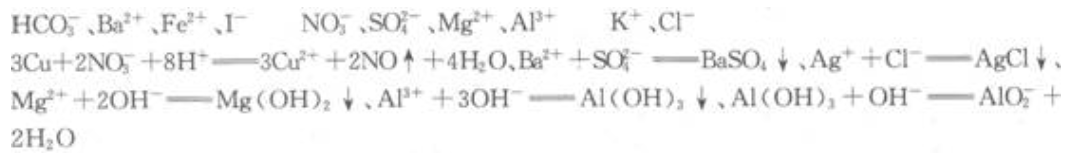
简答题
1、如图所示,在磁感应强度为B的匀强磁场中,有两条相距为L的平行金属导轨,磁场垂直导轨平面,导轨两端分别与电阻R1和R2连接.图中MN为放置在导轨上的金属棒.金属棒在拉力作用下,向右做速度为V的匀速运动,不计金属棒与导轨之间的摩擦以及金属棒和导轨的电阻,求: (1)电阻R1和R2上各自消耗的热功率P1和P2;
(2)拉力的功率P.
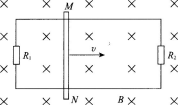
答 案:
2、25℃时用铂电极电解118g CuSO4溶液,当CuSO4电解完全,得到100 mL密度为1.1g/cm3的无色溶液,试计算: (1)原CuSO4溶液的质量分数。
(2)电解后所得溶液中氢离子浓度。
答 案: